高二化学上功课题目及答案—第三章 。 人们总是从失望中走出,接受了现实的磨难,于奋发中明白,遗憾铸就人生。 这里有成都学而思一对一小编为大家收集整理了高二化学上功课题目及答案—第三章 ,希望对大家有帮助。
高二化学上功课题目及答案—第三章
先进节弱电解质的电离
四、题目参考
(一)参考答案
1、
2、氨水中存在的粒子:NH3·H2O、NH4+、OH-
氯水中存在的粒子:Cl2、Cl-、H+、ClO-
3、(1)错。导电能力的强弱取决于电解质溶液中离子的浓度,因此强、弱电解质溶液导电能力与二者的浓度及强电解质的溶解性有关。
(2)错。酸与碱反应生成盐,所需碱的量只与酸的物质的量有关,盐酸和醋酸都是一元酸,物质的量浓度相同的盐酸和醋酸中含有相同物质的量的H+。
(3)错。一水合氨是弱碱,在水溶液中是部分电离的,其电离平衡受氨水浓度的影响,浓溶液的电离程度低于稀溶液。因此氨水稀释一倍时,其OH-浓度降低不到一半。
(4)错。醋酸中的氢没有全部电离为H+。
※(5)错。此题涉及水解较复杂,不要求孩子考虑水解。
4?(1)不变。一定温度下,该比值为常数——平衡常数。
(2)4。18×10-4mol/L
5、(2)木头中的电解质杂质溶于水中,使其具有了导电性。
(二)补充题目
1、25℃时,50mL0。10mol/L醋酸中存在下述平衡:________________________________
若分别作如下改变,对上述平衡有何影响?
(1)加入少量冰醋酸,平衡将________,溶液中c(H+)将____(增大、减小、不变);
(2)加入一定量蒸馏水,平衡将________,溶液中c(H+)将(增大、减小、不变);
(3)加入少量0。10mol/L盐酸,平衡将________,溶液中c(H+)将(增大、减小、不变);
(4)加入20mL0。10mol/LNaCl溶液,平衡将________,溶液中c(H+)将(增大、减小、不变)。
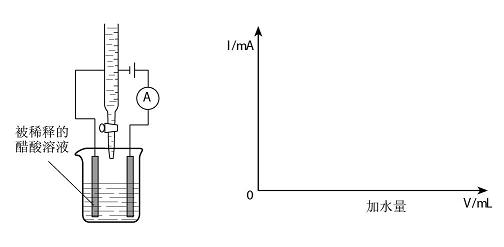
2、已知CH3COOH分子内的相邻原子间都是以共价键结合的,在水分子作用下,可以电离产生CH3COO-和H+。并且,溶液的导电能力将随着溶液中离子浓度的增大而增强。
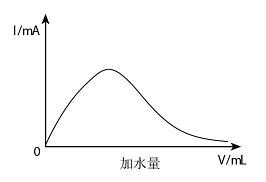
向盛有2mL冰醋酸的烧杯中,滴加一定量水使其稀释为0。001mol/L的醋酸溶液,同时测量通过该溶液的电流强度(实验装置如下图所示)。试在下面的坐标图中绘出电流计中指示的电流强度随着加水量增多而发生变化的图象。
参考答案:
1、(1)向电离方向移动,增大;(2)向电离方向移动,减小;(3)向离子结合成分子的方向移动,增大;(4)向电离方向移动,减小。
2、见图。
第二节水的电离和溶液的酸碱性
四、题目参考
(一)参考答案
1、③④①②;②①④③。
2、NH+4,OH-,NH3·H2O,H+。
3、C;4?A;5?D;6?D;7?A;8?A、D。
9、注:不同品牌的同类物品,其相应的pH可能不尽相同。
10、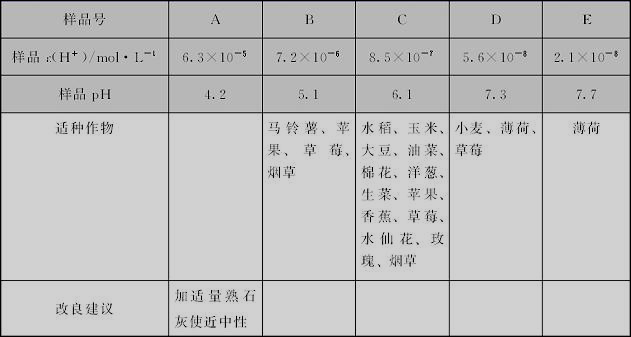
11、(1)酸性(2)10,1×10-4??(3)9mL
(二)补充题目
1、把1mL0。1mol/L?H2SO4溶液加水稀释成2L溶液,在此溶液中H+,其浓度接近于()。
A?1×10-4mol/LB?1×10-8mol/L
C?1×10-11mol/LD?1×10-10mol/L
2、99℃时,Kw=1×10-12,在该温度下,将1mL0。1mol/LKOH溶液加水稀释至1L,则溶液的pH为;若加水稀释至1000L,则溶液的pH为。
参考答案:
1、A。
2、稀释至1L时,pH为8;稀释至1000L时,pH为6。
第三节盐类的水解
四、题目参考
(一)参考答案
1、D;?2。B;3。C;?4。D。
5、乙,如果是弱酸,所生成的盐电离出的A-会部分地与水电离出的H+结合成HA,则c(A-)≠c(M+)。
6、>,Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+AlO2-+2H2O;
=,2Al3++3SO42-+3Ba2++6OH-=3BaSO4↓+2Al(OH)3↓
7、CO32-+H2O=HCO3-+OH-,Ca2++CO32-=CaCO3↓
8、Na2CO3溶液的pH>NaHCO3溶液的pH,因为由HCO3-电离成CO32-比由H2CO3电离成HCO3-更难,即Na2CO3与NaHCO3是更弱的弱酸盐,所以水解程度会大一些。
9、(1)SOCl2+H2O?SO2↑+2HCl↑
(2)AlCl3溶液易发生水解,AlCl3·6H2O与SOCl2混合加热,SOCl2与AlCl3·6H2O中的结晶水作用,生成无水AlCl3及SO2和HCl气体。
10、加水的效果是增加水解反应的反应物c(SbCl3),加氨水可中和水解反应生成的HCl,以减少生成物c(H+),两项操作的作用都是使化学平衡向水解反应的方向移动。
※11。受热时,MgCl2·6H2O水解反应的生成物HCl逸出反应体系,相当于不断减少可逆反应的生成物,从而可使平衡不断向水解反应方向移动;MgSO4·7H2O没有类似可促进水解反应进行的情况。
(二)补充题目
泡沫灭火器内装有NaHCO3饱和溶液,该溶液呈碱性的原因是:_____________;灭火器内另有一容器中装有Al2(SO4)3溶液,该溶液呈酸性的原因是:____________。当意外失火时,使泡沫灭火器倒过来即可使药液混合,喷出CO2和Al(OH)3,阻止火势蔓延。其相关的化学方程式为:_________________。
参考答案:HCO3-+H2O?H2CO3+OH-
Al3++3H2O?Al(OH)3+3H+
Al3++3HCO3-?Al(OH)3↓+3CO2↑
第三节难溶电解质的溶解平衡
四、题目参考
(一)参考答案
1、文字描述略。
2、C;3、D;4、C。
5、(1)S2-与H+作用生成的H2S气体会逸出反应体系,使FeS的沉淀溶解平衡向溶解方向移动。
(2)硫酸钙也难溶于水,因此向碳酸钙中加硫酸是沉淀转化的问题,但硫酸钙的溶解度大于碳酸钙,转化不能实现。醋酸钙溶于水,且醋酸提供的H+与碳酸钙沉淀溶解平衡中的CO32-作用,可生成CO2逸出反应体系,使其沉淀溶解平衡向溶解的方向移动。
(3)硫酸溶液中的SO42-对BaSO4的沉淀溶解平衡有促进平衡向生成沉淀的方向移动的作用。
6、略。
(二)补充题目
1、要除去MgCl2酸性溶液里少量的FeCl3,不宜选用的试剂是()。
(A)MgO(B)MgCO3(C)NaOH(D)Mg(OH)2
2、已知25℃,AgI的饱和溶液中c(Ag+)为1。22×10-8mol/L,AgCl的饱和溶液中c(Ag+)为1。25×10-5mol/L。若在5mL含有KCl和KI各为0。01mol/L的溶液中,加入8mL0。01mol/LAgNO3溶液,这时溶液中所含溶质的离子浓度由大到小的次序是:____________。
参考答案:
1、C;2、c(K+)>c(NO3-)>c(Cl-)>c(Ag+)>c(I-)。
高二化学上功课题目及答案—第三章 小编就介绍到这里,希望对有需要的同学提供帮助,暑假愉快的时光过去了,新的学习即将开启,希望同学们在新的学习生活里发光发热,更上一层楼,更多试题辅导,可以添加Q群:651207579(高中资料分享群)或请拨打免费咨询电话:4000-121-121!



 请加入QQ群,试题资料免费放送!
请加入QQ群,试题资料免费放送!

 保存 |
保存 |
 打印 |
打印 |
 关闭
关闭
