预约小初高体验课 享受1对1辅导
各位家长请注意:此表单用于预约体验课,不想预约的家长,请勿填写
| 高一衔接 | 2021高一高二开学资料领取[ 戳我下载 ] |
| 高中资料 | 2021及历年高一期末高二期末试卷真题及答案[ 戳我下载 ] |
| 【新高考福利】备考规划+全科复习资料[ 戳我下载 ] |
速度收藏!电化学知识总结+题目,电化学是化学学习的重点,学而思1对1小编综合知识为大家整理了这篇速度收藏!电化学知识总结+题目。希望对广大孩子在学习化学时有所帮助
速度收藏!电化学知识总结+题目
知识总结
一、原电池:
(一)概念:化学能转化为电能的装置叫做原电池。
(二)组成条件:
1、两个活泼性不同的电极
2、电解质溶液
3、电极用导线相连并插入电解液构成闭合回路
(三)电子流向:
外电路:负极——导线——正极
内电路:盐桥中阴离子移向负极的电解质溶液,盐桥中阳离子移向正极的电解质溶液。
(四)电极反应:
以锌铜原电池为例:
负极:氧化反应:Zn-2e=Zn2+(较活泼金属)
正极:还原反应:2H++2e=H2↑(较不活泼金属)
总反应式:Zn+2H+=Zn2++H2↑
(五)正、负极的判断:
1、从电极材料:一般较活泼金属为负极;或金属为负极,非金属为正极。
2、从电子的流动方向:负极流入正极
3、从电流方向:正极流入负极
4、根据电解质溶液内离子的移动方向:阳离子流向正极,阴离子流向负极
5、根据实验现象:
(1)溶解的一极为负极
(2)增重或有气泡一极为正极
二、化学电池
(一)电池的分类:化学电池、太阳能电池、原子能电池
(二)化学电池:借助于化学能直接转变为电能的装置
(三)化学电池的分类:一次电池、二次电池、燃料电池
1、一次电池
常见一次电池:碱性锌锰电池、锌银电池、锂电池等
2、二次电池
(1)二次电池:放电后可以再充电使活性物质获得再生,可以多次重复使用,又叫充电电池或蓄电池。
(2)电极反应:铅蓄电池
放电:
负极(铅):Pb-2e-=PbSO4↓
正极(氧化铅):PbO2+4H++2e-=PbSO4↓+2H2O
充电:
阴极:PbSO4+2H2O-2e-=PbO2+4H+
阳极:PbSO4+2e-=Pb
两式可以写成一个可逆反应:PbO2+Pb+2H2SO4?2PbSO4↓+2H2O
(3)目前已开发出新型蓄电池:银锌电池、镉镍电池、氢镍电池、锂离子电池、聚合物锂离子电池
3、燃料电池
(1)燃料电池:是使燃料与氧化剂反应直接产生电流的一种原电池
(2)电极反应:一般燃料电池发生的电化学反应的较终产物与燃烧产物相同,可根据燃烧反应写出总的电池反应,但不注明反应的条件。负极发生氧化反应,正极发生还原反应,不过要注意一般电解质溶液要参与电极反应。以氢氧燃料电池为例,铂为正、负极,介质分为酸性、碱性和中性。
①当电解质溶液呈酸性时:
负极:2H2-4e-=4H+
正极:O2+4e-+4H+=2H2O
②当电解质溶液呈碱性时:
负极:2H2+4OH--4e-=4H2O
正极:O2+2H2O+4e-=4OH-
另一种燃料电池是用金属铂片插入KOH溶液作电极,又在两极上分别通甲烷(燃料)和氧气(氧化剂)。电极反应式为:
负极:CH4+10OH--8e-=CO32-+7H2O;
正极:4H2O+2O2+8e-=8OH-。
电池总反应式为:CH4+2O2+2KOH=K2CO3+3H2O
(3)燃料电池的优点:能量转换率高、废弃物少、运行噪音低
4、废弃电池的处理:回收利用
三、电解池
(一)电解原理
1、电解池:把电能转化为化学能的装置,也叫电解槽。
2、电解:电流(外加直流电)通过电解质溶液而在阴阳两极引起氧化还原反应(被动的不是自发的)的过程。
3、放电:当离子到达电极时,失去或获得电子,发生氧化还原反应的过程。
4、电子流向:(电源)负极—(电解池)阴极—(离子定向运动)电解质溶液—(电解池)阳极—(电源)正极。
5、电极名称及反应:
阳极:与直流电源的正极相连的电极,发生氧化反应
阴极:与直流电源的负极相连的电极,发生还原反应
6、电解CuCl2溶液的电极反应:
阳极:2Cl--2e-=Cl2(氧化)
阴极:Cu2++2e-=Cu(还原)
总反应式:CuCl2=Cu+Cl2↑
7、电解本质:电解质溶液的导电过程,就是电解质溶液的电解过程
☆规律总结:电解反应离子方程式书写:
放电顺序:
阳离子放电顺序:Ag+>Hg2+>Fe3+>Cu2+>H+(指酸电离的)>Pb2+>Sn2+>Fe2+>Zn2+>Al3+>Mg2+>Na+>Ca2+>K+
阴离子的放电顺序:
是惰性电极时:S2->I->Br->Cl->OH->NO3->SO42-(等含氧酸根离子)>F-
是活性电极时:电极本身溶解放电
*注先要看电极材料,是惰性电极还是活性电极,若阳极材料为活性电极(Fe、Cu)等金属,则阳极反应为电极材料失去电子,变成离子进入溶液;若为惰性材料,则根据阴阳离子的放电顺序,依据阳氧阴还的规律来书写电极反应式。
电解质水溶液电解产物的规律:

上述四种类型电解质分类:
(1)电解水型:含氧酸,强碱,活泼金属含氧酸盐
(2)电解电解质型:无氧酸,不活泼金属的无氧酸盐(氟化物除外)
(3)放氢生碱型:活泼金属的无氧酸盐
(4)放氧生酸型:不活泼金属的含氧酸盐
(二)电解原理的应用
1、电解饱和食盐水以制造烧碱、氯气和氢气
(1)电镀应用电解原理在某些金属表面镀上一薄层其他金属或合金的方法
(2)电极、电解质溶液的选择:
阳极:镀层金属,失去电子,成为离子进入溶液M—ne-==Mn+
阴极:待镀金属(镀件):溶液中的金属离子得到电子,成为金属原子,附着在金属表面Mn++ne-==M
电解质溶液:含有镀层金属离子的溶液做电镀液镀铜反应原理
阳极(纯铜):Cu-2e-=Cu2+
阴极(镀件):Cu2++2e-=Cu,
电解液:可溶性铜盐溶液,如CuSO4溶液
2、电镀应用之一:铜的精炼
阳极:粗铜;
阴极:纯铜
电解质溶液:硫酸铜
3、电冶金
(1)电冶金:使矿石中的金属阳离子获得电子,从它们的化合物中还原出来用于冶炼活泼金属,如钠、镁、钙、铝
(2)电解氯化钠:
通电前,氯化钠高温下熔融:NaCl==Na++Cl-
通直流电后:
阳极:2Na++2e-==2Na
阴极:2Cl-—2e-==Cl2↑
☆规律总结:原电池、电解池、电镀池的判断规律


(1)若无外接电源,又具备组成原电池的三个条件。
①有活泼性不同的两个电极;
②两极用导线互相连接成直接插入连通的电解质溶液里;
③较活泼金属与电解质溶液能发生氧化还原反应(有时是与水电离产生的H+作用),只要同时具备这三个条件即为原电池。
(2)若有外接电源,两极插入电解质溶液中,则可能是电解池或电镀池;当阴极为金属,阳极亦为金属且与电解质溶液中的金属离子属同种元素时,则为电镀池。
(3)若多个单池相互串联,又有外接电源时,则与电源相连接的装置为电解池成电镀池。若无外接电源时,先选较活泼金属电极为原电池的负极(电子输出极),有关装置为原电池,其余为电镀池或电解池。
☆原电池,电解池,电镀池的比较
四、金属的电化学腐蚀和防护
(一)金属的电化学腐蚀
1、金属腐蚀内容
2、金属腐蚀的本质:都是金属原子失去电子而被氧化的过程
3、电化学腐蚀和化学腐蚀的区别

4、电化学腐蚀的分类:
析氢腐蚀——腐蚀过程中不断有氢气放出
(1)条件:潮湿空气中形成的水膜,酸性较强(水膜中溶解有CO2、SO2、H2S等气体)
(2)电极反应:
负极:Fe–2e-=Fe2+
正极:2H++2e-=H2↑
总式:Fe+2H+=Fe2++H2↑
吸氧腐蚀——反应过程吸收氧气
①条件:中性或弱酸性溶液
②电极反应:
负极:2Fe–4e-=2Fe2+
正极:O2+4e-+2H2O=4OH-
总式:2Fe+O2+2H2O=2Fe(OH)2
生成的Fe(OH)2被空气中的O2氧化,生成Fe(OH)3,Fe(OH)3脱去一部分水就生成Fe2O3·xH2O(铁锈主要成分)
规律总结:
1、金属腐蚀快慢的规律:在同一电解质溶液中,金属腐蚀的快慢规律如下:
电解原理引起的腐蚀>原电池原理引起的腐蚀>化学腐蚀>有防腐措施的腐蚀
2、防腐措施由好到坏的顺序如下:
外接电源的阴极保护法>牺牲负极的正极保护法>有一般防腐条件的腐蚀>无防腐条件的腐蚀
(二)金属的电化学防护
1、利用原电池原理进行金属的电化学防护
(1)牺牲阳极的阴极保护法
原理:原电池反应中,负极被腐蚀,正极不变化
应用:在被保护的钢铁设备上装上若干锌块,腐蚀锌块保护钢铁设备
负极:锌块被腐蚀;正极:钢铁设备被保护
(2)外加电流的阴极保护法
原理:通电,使钢铁设备上积累大量电子,使金属原电池反应产生的电流不能输送,从而防止金属被腐蚀
应用:把被保护的钢铁设备作为阴极,惰性电极作为辅助阳极,均存在于电解质溶液中,接上外加直流电源。通电后电子大量在钢铁设备上积累,抑制了钢铁失去电子的反应。
2、改变金属结构:把金属制成防腐的合金
3、把金属与腐蚀性试剂隔开:电镀、油漆、涂油脂、表面钝化等
(3)金属腐蚀的分类:
化学腐蚀—金属和接触到的物质直接发生化学反应而引起的腐蚀。
电化学腐蚀—不纯的金属跟电解质溶液接触时,会发生原电池反应。比较活泼的金属失去电子而被氧化,这种腐蚀叫做电化学腐蚀。






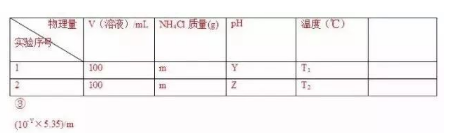
速度收藏!电化学知识总结+题目已经为大家整理好了。感谢您的阅读。如果大家想咨询学而思1对1课程和8人班小组课程,可以拨打4000-121-121。如果大家想一起探讨学习和诊断欢迎大家加入智康QQ群,里面有老师为你解答。小学②群:213965478、中考家长交流①群:230753443、高中交流群:228799125还可以微信搜索“成都学而思1对1”微信号:cdxrs1d1,更多学习资料等你下载!
 请加入QQ群,试题资料免费放送!
请加入QQ群,试题资料免费放送!

 保存 |
保存 |
 打印 |
打印 |
 关闭
关闭
